Неутешительные результаты лечения парапротезной инфекции, высокая летальность и частота ампутаций конечности заставляют хирургов искать новые пути профилактики и лечения этого грозного осложнения. До настоящего времени не выработано единой обоснованной тактики при различных формах ППИ.
При нагноении вокруг синтетических протезов консервативное лечение (или так называемая активно-выжидательная тактика), как правило, не приводит к купированию воспаления и чревато развитием кровотечения из зоны анастомозов или тромбоза протеза. Практически все авторы считают ППИ абсолютным показанием к хирургическому лечению, однако объем предлагаемого хирургического вмешательства варьирует от резекции и замены инфицированного участка протеза ауто-, го-мо- или ксеноматериалом in situ до тотального удаления протеза во всех случаях инфекции с обходным экстраанатомическим шунтированием.
С учетом современных принципов ключевым звеном комплексного лечения раневой инфекции является радикальная хирургическая обработка гнойного очага. По отношению к ППИ это означает широкое рассечение всех обнаруженных «карманов». Вмешательство должно заключаться в полном удалении всех воспаленных и рубцово-измененных мягких тканей. Целесообразно применение таких дополнительных физических методов обработки, как низкочастотная ультразвуковая обработка раны и обнаженного участка протеза через растворы антибиотиков или антисептиков, или обработка раны пульсирующей струей антибактериальных препаратов. Помимо дополнительной механической очистки и удаления с поверхности протеза биопленки, содержащей микроорганизмы, это способствует активизации микроцирку-
ляции, а также позволяет создать в поверхностном слое тканей и протеза значительную концентрацию антибактериального препарата. Всем больным показаны парентеральная антибактериальная терапия с учетом чувствительности микрофлоры, ан-тикоагулянтная и антиагрегантная терапия.
Вопрос о судьбе инфицированного протеза должен решаться в каждом случае индивидуально в зависимости от распространенности гнойного процесса, адекватности функции шунта, степени изменений окружающих тканей, а также общего состояния пациента и характера сопутствующих заболеваний. Рассмотрим положительные и отрицательные стороны различных вариантов хирургической тактики.
Удаление протеза без одномоментного повторного протезирования производят в случае тромбоза инфицированного трансплантата и отсутствия критической ишемии конечности. Важным является тотальное удаление всего протеза, так как, по нашему мнению, это не только позволяет более надежно справиться с гнойным осложнением, но и снижает риск инфекции при повторных отсроченных вмешательствах в этой зоне. Если необходима пластика зоны проксимального анастомоза, используют заплаты из аутовены. При удалении инфицированного аортального протеза аорту ушивают двойным швом и укрывают прядью сальника или предпозвоночной фасцией. Исключение составляют случаи, когда вторичное инфицирование протеза происходило в результате нагноения раны культи бедра после ампутации по поводу тромбоза бранши аортоби-феморального протеза. Полное удаление инфицированной бранши протеза позволило сохранить единственную конечность 4 пациентам. В одном случае распространение гнойного процесса на вторую браншу привело к необходимости тотального удаления протеза с подмышечно-бедрен-ным обходным шунтированием.
Повторная реконструктивная операция после купирования инфекции сопряжена с повышенным риском рецидива нагноения и должна выполняться в отсроченном периоде по строгим показаниям. В этих случаях вопросам профилактики инфекции должно быть уделено самое пристальное внимание.
Удаление инфицированного протеза с обходным экстраанатомическим шунтированием применяют с 60-х годов , и в настоящее время оно считается методом выбора при инфицировании протеза . Действительно, полное удаление протеза позволяет быстро и надежно ликвидировать гнойный процесс, при этом риск нагноения шунта, проведенного в интактных тканях, значительно ниже, чем при повторной пластике in situ. При локализации гнойного очага в паху и верхней трети бедра оптимальным является проведение протеза в обход инфицированной зоны через обтураторное отверстие как наиболее прямой и короткий путь экстраанатомического шунтирования.
В случаях массивного вовлечения в гнойный процесс мягких тканей внутренней поверхности бедра целесообразно проведение армированного подвздошно-подколенного шунта над гребнем подвздошной кости по наружной поверхности бедра в подколенную область. Подобные вмешательства выполнены нами у 4 больных, причем в 3 случаях удалось сохранить конечность.
При инфицировании протеза аорты единственным надежным методом купирования инфекции и профилактики профузного кровотечения на сегодняшний день является удаление аллопротеза с обходным подклю-чично-бедренным шунтированием. Нами такие операции выполнены у 3 больных. Схемы операций представлены на рис. 6.75—6.78.
К недостаткам указанной тактики лечения можно отнести опасность
повреждения запирательных сосудов при «обтураторном» шунтировании, а также значительную частоту тромбоза длинных извитых обходных протезов. При использовании подключич-но-бедренного шунтирования целесообразно выполнение в отдаленном периоде реконструкции проксимального анастомоза с имплантацией протеза в аорту.
Полное или частичное удаление инфицированного протеза с одномоментной заменой in situ на ауто- или ксеноматериал применяется рядом авторов в качестве альтернативы обходному шунтированию . При этом основной проблемой является высокая частота рецидивов инфекции. Авторы, использующие парциальное удаление с ре-протезированием in situ, отмечают, что более чем в 1/3 случаев происходит реинфицирование протеза в отдаленные сроки.
Для профилактики повторного инфицирования сосудистых трансплантатов предложены различные пластические материалы. Наиболее надежно купировать инфекцию удается при использовании аутовены. В частности, A.Nevelsteen и соавт. (1997) предложили использование бедренной вены в старом ложе протеза при инфекции аортобедренного трансплантата. Во всех случаях удалось устранить инфекцию трансплантатов, однако отдаленные результаты оказались неудовлетворительными в связи с тромботически-ми осложнениями и проявлениями венозной недостаточности. Использование большой подкожной вены в значительном числе случаев оказывается невозможным из-за резкого несоответствия диаметров сосудов.
Другим перспективным направлением лечения ППИ является использование протезов с антибактериальными свойствами. В последние годы появились многочисленные работы, посвященные применению протезов, импрегнированных различными антибиотиками, однако главным об-
12-4886
Рис. 6.75. Экстраанатомическое подвздошно-бедренное шунтирование через запирательное отверстие.
Рис. 6.76. Экстраанатомическое подвздошно-подко-ленное шунтирование с огибанием крыла подвздошной кости и медиальным доступом к подколенной артерии выше щели коленного сустава.
Рис. 6.77. Экстраанатомическое подвздошно-под-коленное шунтирование с огибанием крыла подвздошной кости и латеральным доступом к подколенной артерии ниже щели коленного сустава.
разом они касаются доклинических исследований. P.D.Hayes (1999) для замены инфицированного трансплантата использовал у 11 пациентов протезы, пропитанные рифампици-ном. Рецидив ППИ у 2 больных сопровождался тяжелыми осложнениями — сепсисом и кровотечением, в 7 случаях достигнуто стойкое купирование инфекции. Развитие этого, несомненно, прогрессивного направле-
ния в настоящее время тормозят две основные нерешенные проблемы: создание длительной эффективной концентрации антибиотика в тканях вокруг протеза и чувствительность конкретного штамма микроорганизмов к используемому антибиотику.
Сохранение инфицированного протеза представляет наименее травматичный путь лечения ППИ. В своей работе мы пытаемся сохранить про-
тез при соблюдении следующих условий:
-
сохранение проходимости протеза и отсутствие признаков ишемии дистальных отделов конечности;
-
отсутствие признаков инфицирования зоны анастомозов или их несостоятельности (кровотечение в анамнезе, наличие ложной аневризмы);
-
отсутствие признаков эндовас-кулярной инфекции и бактериемии;
-
отсутствие ишемических и воспалительных изменений в мышцах, окружающих протез.
В наших наблюдениях этим условиям соответствовали 10 случаев.
После вскрытия гнойного очага и радикальной хирургической обработки раны во время ежедневных перевязок раневую поверхность и особенно обнаженный участок протеза обрабатывали низкочастотным ультразвуком через растворы антисептиков. После купирования явлений воспаления, снижения бактериальной обсемененности раны до 101—2 микробных тел в 1 г ткани и перехода раневого процесса в фазу регенерации по данным цитологического исследования выполняли повторную хирургическую обработку с полным иссечением всех измененных тканей, включая грануляции и уплотненные участки краев и дна раны. Раневую и обнаженную поверхности эндопро-теза дополнительно обрабатывали низкочастотным ультразвуком через 1 % раствор диоксидина.
В литературе описано использование широкого спектра лоскутов для пластики парапротезной зоны . При локализации гнойного процесса в паху и верхней трети бедра мы использовали у 6 пациентов лоскуты m.gracilis и m.sarto-rius, так как сегментарный тип кровоснабжения этих мышц дает возможность формировать длинные и относительно тонкие лоскуты, позволяющие укрыть практически любой участок протеза в паху и на бедре. Это выгодно отличает их от предлагаемых лоскутов m.vastus lateralis и
Рис. 6.78. Подключично-бедренное шунтирование.
m.semitendinosus. Кроме того, выпадение функции одной из этих мышц практически не сказывается на объеме движений в конечности в отличие от лоскута прямой мышцы живота на дистальной питающей ножке, после использования которого в ряде случаев наблюдаются асимметрия и слабость передней брюшной стенки.
| Видео (кликните для воспроизведения). |
При пластике области брахиоце-фальных артерий нами в одном случае использован лоскут большой грудной мышцы. В 2 случаях при сочетании ППИ с передним медиастинитом применен лоскут большого сальника.
Лоскут выкраивали с таким расчетом, чтобы при его перемещении не возникало натяжения лоскута или сдавления шунта.
12*
В течение первых 10 дней у всех больных применяли направленную парентеральную антибактериальную терапию с учетом чувствительности выделенного штамма микроорганизмов. В последующем проводили длительную (до 1 мес) антибактериальную профилактику пероральными препаратами с учетом чувствительности микрофлоры.
Приводим клинический пример.
Больной Т., 70 лет, поступил в отделение ран и раневой инфекции с клинической картиной флегмоны левого бедра. В анамнезе в 1993 г. — бедренно-подколен-ное шунтирование протезом «Goretex» по поводу атеросклеротической окклюзии. Через 3,5 года после операции на фоне тромбофлебита большой подкожной вены развилась клиническая картина флегмоны. При поступлении состояние больного средней тяжести, лихорадка до38,6 °С. Внутренние органы без патологических изменений. Артериальная гипертония 150—160/80 мм рт.ст. Местно — наличие инфильтрата в средней трети бедра с зоной флюктуации в центре, зона гиперемии и пастозности кожи по внутренней поверхности бедра до нижней трети.
Больной в срочном порядке обследован. При компьютерной томографии выявлено 2 изолированных гнойника по ходу протеза: вскрытый проксимальный — в пределах подкожной клетчатки и не-дренированный дистальный — в нижней трети бедра, непосредственно связанный с портняжной мышцей. Данных о вовлечении в гнойный процесс проксимального и дистального анастомозов не обнаружено.
При дуплексном сканировании выявлено, что протез полностью проходим, инфильтрация тканей в области анастомозов отсутствует, в нижней трети бедра вдоль протеза имеется зона разрежения размером 8 х 2,5 см, трактовавшаяся как гнойная полость.
В послеоперационном периоде проводили антибактериальную терапию с учетом чувствительности микрофлоры (ци-профлоксацин по 200 мг 2 раза в сутки внутривенно), ежедневную обработку раны и протеза низкочастотным ультразвуком через растворы диоксидина и хи-мотрипсина, перевязки с диоксидиновой мазью.
После купирования явлений гнойного воспаления выполнены повторная хирургическая обработка и пластика па-рапротезного пространства перемещенным лоскутом m.gracilis (рис. 6.79, б).
Послеоперационный период протекал гладко, рана зажила первичным натяжением (рис. 6.79, в). Антибактериальная терапия ципрофлоксацином (по 500 мг2 раза в день per os) в течение 3 нед. Контрольный осмотр через 2 года 6 мес: признаков воспаления нет, шунт функционирует, признаки ишемии конечности отсутствуют, при контрольном УЗИ мышечный лоскут плотно прилежит к протезу, жидкостных скоплений не определяется (рис. 6.79, г).
В результате проведенного лечения удалось сохранить 7 из 10 протезов со сроком послеоперационного наблюдения от 4 мес до 5 лет. В 3 случаях отмечен тромбоз шунта, что потребовало выполнения обходного экстраанатомического шунтирования у 1 больного. Рецидива инфекции в наших наблюдениях не отмечено. Таким образом, наши наблюдения позволяют отказаться от пессимистичного взгляда на судьбу инфицированных сосудистых протезов, что согласуется с данными литературы.
Следует отметить, что только сочетание радикальной хирургической обработки гнойного очага, дополнительных методов обработки раны, направленной антибактериальной терапии и пластики парапротезной зоны васкуляризованным лоскутом дает надежду на сохранение функционирующего имплантата и стойкую ликвидацию проявлений инфекции.
Мы ни в коем случае не склонны предлагать сохранение инфициро-
Рис. 6.79. Клиническое наблюдение.
а — вскрыт абсцесс внутренней поверхности бедра в области бедренно-подколенного протеза «Гортекс»; б — выполнена хирургическая обработка раны и пластика перипротезной зоны мобилизованным лоскутом m. gracilis; в — послеоперационное течение без осложнений, рана зажила первичным натяжением; г — контрольное УЗИ через 2 года 6 мес: протез функционирует, мышечный лоскут плотно прилежит к протезу, жидкостных скоплений не определяется.
ванного протеза в качестве метода выбора для всех случаев гнойной инфекции в хирургии сосудов, однако считаем, что в некоторых строго определенных случаях он может стать достойной альтернативой ампутации конечности.
Лечение без посредников в Университетском МЦ Пория
Гарантируем низкие цены на лечение в Израиле
Оплата в кассу больницы
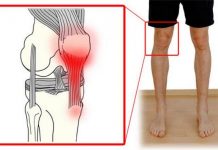
Полная замена коленного сустава (эндопротезирование) является одной из самых успешных ортопедических процедур ХХ века. Эта операция, выполняемая в нашем Медицинском Центре Пория, Израиль, позволяет существенно облегчить боль в колене и обеспечить восстановление его функций. Также мы выполняем онкологические операции по удалению опухоли в костях с заменой сустава. Улучшенные хирургические материалы и новые эффективные технологии значительно увеличили успех процедуры.
С появлением новых материалов и конструкций имплантатов и улучшением хирургических методов, от тотального эндопротезирования коленного сустава можно ожидать долговременное функционирования, в течение, по крайней мере, 15 до 20 лет в более чем у 85-90% больных. Тем не менее, не всегда можно добиться успеха при первой операции, особенно в случае рака кости и иногда пациенту может потребоваться вторая операция, которая называется повторное эндопротезирование коленного сустава.
Повторное эндопротезирование коленного сустава
Ревизионная хирургия коленного сустава — это замена предыдущего неудачного эндопротезирования новым протезом. Это сложная процедура, которая требует обширной предоперационной подготовки, специализированных персональных имплантатов и инструментов, а также от хирурга – большой опыт эндопротезирования и владение сложными хирургическими методами, для гарантии хорошего результата.
Почему имплантаты не всегда приживаются?
Есть несколько причин для отказа функционирования имплантатов колена. К ним относятся износ, ослабление, инфекция, перелом, нестабильность, а также факторы, связанные с:
- Износ и разрушение костной ткани
Нормальное функционирование имплантатов зависят от их фиксации к кости; фиксация достигается обычно путем склеивания имплантата и кости. Некоторые хирурги предпочитают использовать биологическую (не склеивающую) фиксацию.
Хотя имплантаты прочно закреплены на начальном этапе замены коленного сустава, они могут ослабнуть с течением времени. Трение, вызванное трением суставов, точит поверхности имплантата, создавая крошечные частицы, которые накапливаются вокруг сустава. Процесс называется асептическим (неинфицированным) некрозом, связь имплантата и кости разрушается попыткой организма переваривать частицы износа. Во время этого процесса, здоровые кости также перевариваются (состояние, называемое остеолиз), что может ослабить или даже спровоцировать перелом кости.
Когда протез становится слабым, пациент может испытывать боль, изменения в выравнивании, или нестабильность. Асептическое расшатывание является наиболее распространенной причиной выхода из строя коленных имплантов.
- Инфекция
Инфекция является разрушительным осложнением любой хирургической процедуры. В тотальном эндопротезировании коленного сустава, крупные металлические и пластиковые имплантаты могут служить в качестве места распространения бактерий, которые могут стать невосприимчивыми к антибиотикам. Даже если имплантаты остаются хорошо закрепленными, боль, отек, и дренаж от инфекции вызовет необходимость в операции по доработке. При нынешних хирургических методиках и схемах антибиотикотерапии, риск заражения при тотальном эндопротезировании коленного сустава составляет менее 1%.
Операция по замене зараженного коленного сустава принимает различные формы. В зависимости от степени заражения и повреждения, принимают решение либо о простом вымывании колена с сохранением элементов или о полной замене имплантатов.
В большинстве случаев инфицирования при протезировании коленного сустава, требуются две операции: во-первых, чтобы удалить старый протез и вставить блок цемента с антибиотиками и вторую операцию, чтобы удалить прокладку и вставьте новый протез. Необходимо проводить внутривенное введение антибиотиков в течение этого периода, чтобы вылечить инфекцию.
- Переломы
Необходимость операции по доработке зависит от типа и степени разрушения. Перипротезные переломы (переломы вокруг имплантатов колена), которые нарушают стабильность имплантата, требуют операции по доработке.
- Нестабильность сустава
Нестабильность происходит, когда структуры мягких тканей вокруг коленного сустава не в состоянии обеспечить стабильность, необходимую для адекватной функции при стоянии или ходьбе. Нестабильность может быть результатом увеличения мягких тканей (люфт), недостаточной гибкости имплантатов или неправильной установки или выравнивания протеза. Боль и / или чувство «выхода» колена может изменить функцию коленного сустава и требуют повторного хирургического вмешательства.
| Видео (кликните для воспроизведения). |
Связанные с пациентом факторы риска: возраст, уровень активности, перенесенные ранее операции и лишний вес – все это может способствовать появлению проблем при операции. Молодые, более активные пациенты имеют более высокий уровень риска проведения повторной операции, нежели пожилые, менее активные пациенты. Пациенты с ожирением имеют более высокий риск износа и расшатывания имплантата. Пациенты, которым ранее проводились операции на коленях, подвергаются более высокому риску инфицирования и разрушения имплантата.
Источники:
- Регистр лекарственных средств России РЛС Доктор. Выпуск 11. Ревматология. — М. : РЛС-2009, 2015. — 512 c.
Здравствуйте! Представляюсь на нашем сайте. Меня зовут Иван Жаров. Я уже более 11 лет работаю ортопедом. В настоящее время являюсь специалистом в этом направлении, хочу помочь всем посетителям сайта решать разнообразные задачи.
Все данные для сайта собраны и тщательно переработаны с целью донести в доступном виде всю нужную информацию. Перед применением описанного на сайте всегда необходима обязательная консультация у специалистов.